导读:近年来,肿瘤免疫治疗取得了令人瞩目的进展。然而,实体瘤的免疫耐药问题依然是横亘在临床医生与科研人员面前的一道难题。本文将从笔者亲身接触的病例出发,结合最新研究动态,带您深入了解曲美木单抗(Tremelimumab)在破解这一难题中的关键作用,并探讨其如何逐步改变实体瘤的治疗格局。
一、免疫治疗为何在实体瘤中屡屡受挫?
作为一名长期关注肿瘤免疫领域的医学观察者,我曾采访过多位临床专家和患者家属,他们普遍反映一个现象:虽然PD-1/PD-L1抑制剂在血液系统肿瘤中表现优异,但在实体瘤如肺癌、肝癌、黑色素瘤等疾病中却常常效果有限。
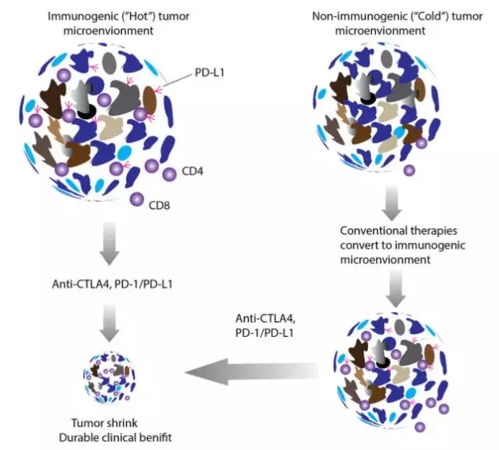
这背后的原因,其实早在数年前就有科学家提出“适应性耐药假说”——当免疫系统试图攻击肿瘤细胞时,肿瘤会通过上调PD-L1表达,与T细胞表面的PD-1结合,形成一种负反馈机制,从而“关闭”免疫反应。这种机制解释了为何增强免疫应答的疗法(如疫苗)在实体瘤中难以奏效。
二、曲美木单抗登场:打破耐药闭环的关键钥匙
就在大家为PD-1/PD-L1单药疗效瓶颈感到困惑时,阿斯利康研发的曲美木单抗(Tremelimumab)进入了公众视野。它是一种靶向CTLA-4的免疫检查点抑制剂,与传统的PD-1抑制剂不同,它的作用机制在于激活T细胞的初始活化阶段,而非仅限于效应阶段。
2024年ESMO大会上公布的HIMALAYA III期试验数据显示:对于未接受过全身治疗且无法手术切除的肝细胞癌(HCC)患者,度伐利尤单抗联合曲美木单抗方案在5年内显示出持续且具有临床意义的总生存获益。这一结果无疑为实体瘤免疫治疗注入了一针强心剂。
“曲美木单抗不仅延长了患者的生存期,更重要的是它改变了我们对免疫治疗组合策略的理解。”——某三甲医院肿瘤科主任李教授
三、双免联合疗法:未来实体瘤治疗的新方向
目前,越来越多的研究开始探索“双免疫检查点阻断”的策略,例如纳武利尤单抗联合伊匹木单抗、或曲美木单抗联合PD-1抑制剂等。这类组合可以同时激活多个免疫通路,打破肿瘤诱导的免疫耐受状态。
以头颈部鳞状细胞癌为例,一项Ⅱ期随机试验纳入了40例可切除患者,分别接受三种新辅助免疫治疗策略:纳武利尤单抗单药、纳武利尤单抗联合伊匹木单抗,以及纳武利尤单抗联合其他药物。结果显示,联合治疗组的病理完全缓解率显著提高,提示免疫微环境被有效重塑。
四、与其他免疫疗法的协同潜力
除了CTLA-4和PD-1靶点外,还有许多新型免疫疗法正在崛起,例如针对LAG-3、TIM-3、FcRn等靶点的单抗药物。这些药物与曲美木单抗联用是否能产生更强的协同效应?已有研究表明,抗LAG-3单抗与抗PD-1单抗的联合在晚期黑素瘤中表现出色,尤其是未接受过PD-1治疗的患者。
此外,像罗泽利昔珠单抗(Rozanolixizumab)这类靶向FcRn的药物也在自免疾病领域取得突破,或许未来也能为肿瘤免疫提供新的思路。
五、挑战仍在:如何优化疗效并减少副作用?
尽管前景广阔,但曲美木单抗并非完美无缺。CTLA-4抑制剂的一个显著问题是其较高的免疫相关不良反应发生率,包括肠炎、肝炎、内分泌紊乱等。因此,如何精准筛选适合该疗法的患者群体、制定个体化的用药方案,成为当前研究的重点。
一些团队正在尝试利用多组学技术分析患者的免疫微环境特征,预测其对双免疗法的响应情况。这种“精准免疫治疗”的理念或将推动肿瘤治疗进入更精细化的时代。
六、结语:一场关于希望的战役
站在2025年的节点回望,曲美木单抗为代表的免疫联合疗法,正逐步改写实体瘤治疗的历史。它不仅为我们提供了新的武器,更让我们重新思考肿瘤与免疫之间的复杂博弈。
作为普通读者或患者家属,我们或许不必深究复杂的分子机制,但了解这些前沿进展,有助于我们在面对癌症时拥有更多选择和信心。正如一位参与HIMALAYA试验的患者所说:“我不是在等待奇迹,而是在参与创造奇迹。”

发表评论 取消回复