在科研的道路上,Western Blot是我们绕不开的一道坎。作为一名生物医学研究者,我亲身经历了无数次WB实验的失败与成功,今天就来和大家聊聊那些年我踩过的坑,以及如何通过一些小技巧让实验更顺利。
问题一:蛋白条带模糊或不清晰?
刚开始做WB的时候,我最头疼的问题就是跑出来的膜上条带模糊、拖尾,甚至根本看不到目标蛋白。后来才知道,这可能跟以下几个因素有关:
- 样品处理不当:蛋白提取过程中没有彻底裂解细胞,或者裂解液保存不当导致蛋白降解。
- 电泳条件不合适:电压太高会导致蛋白迁移过快,条带扩散;电压太低则可能导致分离效果差。
- 转膜时间控制不好:转膜时间过短或电流过大都会影响蛋白转移效率。
小贴士:建议使用预染Marker,并在电泳结束后用Ponceau S染色确认转膜是否成功。
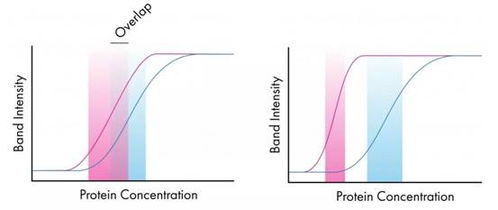
问题二:背景过高怎么办?h2>
很多小伙伴在做WB时会遇到一个普遍问题——背景太亮,几乎看不清目标条带。这个问题其实非常常见,主要原因有:
- 封闭不充分:封闭时间不够或者封闭剂浓度太低,导致抗体非特异性结合。
- 抗体浓度过高:一抗或二抗滴度太高,容易造成非特异性结合。
- 洗膜不彻底:洗涤次数不够或洗涤液配方不对,残留抗体也会导致背景升高。
我的经验:尝试用5%脱脂奶粉封闭1小时,TBST洗膜每次不少于5分钟,共洗3次以上。
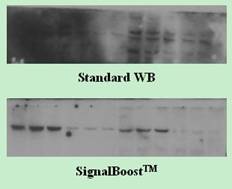
问题三:目的蛋白信号太弱?h2>
有时候明明知道蛋白表达没问题,但就是检测不到信号,这种情况真的很让人崩溃。常见的原因包括:
- 蛋白表达量本身较低:某些蛋白本底表达就很低,需要富集样本。
- 抗体效价不高:不同批次的抗体灵敏度差异大,建议先做预实验验证。
- 曝光时间不足:化学发光法检测时,曝光时间太短也会影响结果。

优化策略:总蛋白校正法
近年来,越来越多的研究者开始采用总蛋白校正(Total Protein Normalization)的方法来替代传统的内参蛋白校正。这种方法的优势在于:
- 避免了内参蛋白在不同组织或处理条件下表达不稳定的问题;
- 减少了对多个抗体的需求,节省成本;
- 提高了数据的准确性和可重复性。
具体操作方法是:在转膜后,使用非特异性蛋白染料(如Ponceau S、Revert 700等)对整个膜进行染色,然后扫描图像,计算每个泳道中总蛋白的含量,再将目的蛋白的信号强度除以该泳道的总蛋白含量,从而实现标准化。
参考来源:仪器信息网相关技术文章指出,总蛋白校正已成为一种新兴且高效的WB数据分析策略。
我的实战经验总结
经过几年的摸索,我总结了一些实用的小技巧,希望对你有所帮助:
- 提前规划好实验流程:从蛋白提取到成像,每一步都要有明确的时间安排。
- 做好对照组:阳性对照、阴性对照、空白对照缺一不可。
- 记录详细:每一次实验都应详细记录试剂批号、操作步骤,方便后期分析问题。
- 善用软件辅助分析:ImageJ、Fiji等工具能大大提高数据处理效率。
如果你也有自己的小妙招,欢迎留言交流!科研路上,我们一起成长。

发表评论 取消回复